Thạch anh là một hợp chất gồm một phần silic và hai phần oxy, silic dioxide, SiO2. Cấu tạo hóa học của nó (và nguyên tố silic, Si) được khám phá ra bởi nhà hóa học Jöns Jakob Berzelius vào năm 1823. Silicon dioxide thường được gọi là silic.
Theo IUPAC, hai tên sau đều đúng: silicon dioxide và dioxosilane
Đây là một mảnh nhỏ silic tinh khiết được sản xuất trong kỹ nghệ. Nó là một nguồn sáng (mật độ 2.328 g/cm3), chất tinh thể xám với nước láng kim loại mạnh. Nó rất cứng (cứng như thạch anh và cứng hơn hầu hết các kim loại), nhưng dễ vỡ và không dễ uốn như kim loại. Silic là nền tảng của chất bán dẫn công nghiệp: silic tinh khiết chỉ là một chất dẫn điện kém, nhưng khi dây kéo những nguyên tố phù hợp được thêm vào, tính dẫn điện của nó như kim loại, và bằng cách chọn loại và lượng nguyên tố, thuộc tính điện của silic có thể được kiểm soát.
Phản ứng
Ở nhiệt độ trong phòng, SiO2 trong sự biến thể hầu như đều trơ và không phản ứng với các chất khác. Thậm chí ở nhiệt độ tương đối cao, về mặt hóa học silica rat ổn định. Với lý do đó, thạch anh kíp (thủy tinh silica) được sử dụng rộng rãi cho các thiết bị hóa học, đặc biệt khi phản ứng xúc tác của ion dương kim loại trong thủy tinh thông thường cần được tránh. Lý do vì phản ứng của silica rất mạnh trong liên kết Si-O, nhưng cấu trúc phân tử lại lớn.
Là thạch cao khan của một axit (axit orthosilicic, H4SiO4), thạch anh nhìn chung không bị tấn công bởi axit. Ngoại lệ nổi bật của axit hydroflourix, HF, sẽ phân hủy thạch anh để hình thành silicon fluoride đầu tiên SiF4, sau đó tới axit hydroflourosilicic:
SiO2 + 6 HF → H2SiF6 + 2 H2O [1]
SiO2 cũng bị tấn công bởi các chất kiềm (như là KOH). Tốc độ phản ứng phụ thuộc vào sự biến đổi và kích cỡ tinh thể: Thạch anh kết tinh sẽ hòa tan rất chậm trong dung dịch kiềm nóng, trong khi SiO2 sẽ hòa tan dễ dàng ở nhiệt độ trong phòng:
SiO2 + 2 KOH → K2SiO3 + H2O [2]
Phản ứng thích hợp với chất phản ứng, bởi dung dịch kiềm và chất tẩy đôi khi được dùng để loại bỏ rêu và địa y từ vật mẫu khoáng sản. Những tinh thể thạch anh thường không phải vấn đề, nhưng tôi sẽ rất cẩn thận khi lau sạch những tinh thể kín khác nhau.
Một phản ứng tương tự dẫn đến sự hình thành chất gel silica trong bê tông, khi hợp chất kiềm của bê tông, đặc biệt Ca(OH)2 phản ứng với silica không kết tinh và thạch anh tinh thể kín (đó là, opal và chalcedony). Gel silica hút nước, sung và làm nứt bê tông trong vài thập kỷ.
Tất cả các dạng silica hòa tan trong natron nấu chảy (Na2CO3) hoặc (K2CO3) để hình thành silicat.
SiO2 + K2CO3 → K2SiO3 + CO2 [3]
Ở nhiệt độ cao trong nhiều môi trường địa chất, thạch anh đóng vai trò như một axit, và phản ứng với các khoáng kiềm. Một ví dụ nổi bật đó là sự hình thành khoáng wollastoniteCa3Si3O9 từ thạch anh và canxit trong quy trình biến chất đá trong nhiệt độ khoảng từ 600°C trở lên:
3 SiO2 + 3 CaCO3 → Ca3Si3O9 + 3 CO2 [4]
Phản ứng đối lập xảy ra trong quá trình phong hóa đá silicat, ví dụ ở đây có axit carbonic H2CO3 trong dung dịch khí tượng thải rag axit silicic và hình thành carbonates[4].
Thạch anh là một kim loại silicon. Silicon được bù lại ở nhiệt độ khoảng 2000°C trong phản ứng thu nhiệt dưới đây:
SiO2 + 2 C → Si + 2 CO [5]
Liên kết Si-O mạnh hơn liên kết C-O, và phản ứng chỉ xảy ra do CO thoát khỏi hệ thống như một khí, nên sự cân bằng phản ứng bị đẩy sang phía bên phải. Sự hình thành CO thay vì CO2 tiêu biểu cho phản ứng khử với carbon ở nhiệt độ cao. Silicon được hình thành trong quy trình này không đủ tinh khiết cho sự sản xuất tinh thể và cần được thực hiện trong trong một quy trình phức tạp hơn. Vì vậy sự phong phú về kim loại của nó, silicon tinh khiết tương đối đắt.
Tính tan trong nước
Tính tan của SiO2 trong nước phụ thuộc vào nhiệt độ, áp suất, cấu trúc bề mặt của nó và sự biến đổi cấu trúc. Bảng dưới đây sẽ khái quát tính tan ở nhiệt độ trong phòng và áp suất thường.
| Chất |
Tính tan trong nước ở 25°C |
| Tinh thể thạch anh dạng tinh thể lớn |
2.9 mg/l [1] / 6-11 mg/l [2] |
| Chalcedony |
22-34mg/l [2] |
| Cristobalite |
6 mg/l [1] |
| Tridymite |
4.5 mg/l [1] |
| Stishovite |
11 mg/l [1] |
| Thủy tinh thạch anh (không kết tinh) |
39 mg/l [1] / 120 mg/l [2] |
Dữ liệu từ:
[1] – ➛Hollemann & Wiberg, 1985
[2] – ➛Rykart, 1995
Ở nhiệt độ trong phòng, trên thực tế, thạch anh không tan trong nước. Vòi nước gần như đều bão hòa với silica hòa tan (tương ứng với thạch anh), và quy trình hòa tan thường rất chậm, vậy nên không cần lo lắng về các tinh thể thạch anh bị phá hủy bởi sự lau chùi liên tục.
Tuy nhiên sự hòa tan silica trong đá và đất đóng vai trò quan trọng trong khí hậu nóng ẩm. Sự hình thành đất đá ong có liên hệ tới silica bị gột rửa khỏi lớp bề mặt và sự giàu có về các hợp chất- ít nhất là dưới những điều kiện khí hậu đó- thì ít tan trong nước, như là oxit sắt, oxit nhôm.
Ở nhiệt độ trên 100°C và áp suất cao, tính tan của thạch anh tăng nhanh. Ở khoảng , nó ở giữa 700 và 1200 mg/l, phụ thuộc vào áp suất.
SiO2 tan trong nước do hình thành axit orthosilicic, H4SiO4:
SiO2 + 2 H2O → H4SiO4 [6]
Axit orthosilicic là một axit rất yếu, yếu hơn axit carbonic. Nó phân ly với pK1 của 9.51 theo phản ứng:
H4SiO4 + H2O ↔ H3SiO4– + H3O+ [7]
Không có phân tử SiO2 hoặc khối tetrahedra SiO4 trong dung dịch nước. Phản ứng đảo là cách thức mà thạch anh mọc ra, nhưng phân tử H4SiO4 không đơn giản là sắp xếp hai phân tử nước, nó cần một phân tử H4SiO4 khác hoặc một phân tử silica sẵn có với met hydroxyt có đuôi (-OH):
H4SiO4 → 2 H2O + SiO2 (không xảy ra trực tiếp) [8]
H4SiO4 + H4SiO4 → H2O + H6Si2O7 [9]
[SinOm]-OH + H4SiO4 → [Sin+1Om+2]-OH + 2 H2O [10]
Axit orthosilicic chỉ ổn định trong dung dịch nước loãng, một dung dịch nước không thể tách được axit tinh khiết. Thuộc tính thú vị nhất của axit orthosilicic là khuynh hướng trùng hợp của nó trong các dung dịch nước để hình thành trước hết là một sol sau đó là met gel axit polysilicic: các phân tử axit orthosilicic tập hợp thành các phân tử lớn theo phản ứng [9] và [10]. Sau khi bạn bắt đầu tập trung vào một dung dịch H4SiO4, các phân tử sẽ trùng hợp. Ở nhiệt độ trong phòng dưới điều kiện phòng thí nghiệm, điểm kết thúc của quy trình là sự hình thành silica vô định hình. Chất gel của axit silicic bị trùng hợp có lẽ là chất tạo ra trước của opal và các đá thạch anh tinh thể kín (theo nghĩa rộng hơn là chalcedony) trong tự nhiên:
Cấu trúc cơ bản của Silica
SiO2 xảy ra không dưới 13 biến thể cấu trúc khác nhau. Những cấu trúc tinh thể của chúng (nếu có) có thể khác nhau, nhưng chúng đều có các thuộc tính cơ bản chung. Thuộc tính dưới đây ứng dụng với mọi biến thể silica trừ những phần được chú ý. Cấu trúc phân tử cụ thể đối với thạch anh được bao quát trong chương Cấu trúc.
Những liên kết hóa học trong silica đều đồng hóa trị: chúng dựa trên quỹ đạo phân tử trong đó hai electron được chia giữa các nguyên tử (đối lập với liên kết ion được tìm thấy trong muối như floutite hay muối bảng; ở đây các electron được chuyển từ một nguyên tố tới một nguyên tố khác để hình thành ion với điện tích trái dấu, và trong mỗi tinh thể những ion đó được xếp cùng nhau do sự hút điện tích.
Khối cấu trúc cơ bản trong hầu hết các biến thể của silica (những trường hợp đặc biệt là những biến thể áp suất cao) là SiO4, trong đó một nguyên tử silicon được bao quanh bởi 4 nguyên 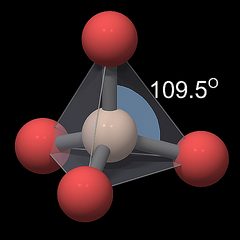 tử oxy.
tử oxy.
.
|O|
– | –
.O-Si-O.
– | –
|O|
.
Hình học của đơn vị này được thể hiện trong hình Fig.1, với silicon được biểu tượng bởi một ngà có màu, oxy được biểu hiện bởi một hình cầu đỏ và kiên kết hóa học được thể hiện bởi những oongsxams giữa chúng. Kích cỡ của các nguyên tử không cân đối. Nguyên tử oxy chiếm vị trí xung q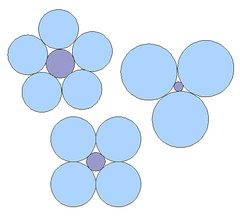 uanh nguyên tử silicon giữ chúng ở khoảng cách xa nhất có thể, nên chúng hình thành bốn góc của met tetrahedron, được tượng trưng bởi hình chop xám trong mờ. Lưu ý rằng nguyên tử oxy không được liên kết với nhau, những đường xám giữa chúng chỉ được vẽ lên để tượng trưng cho hình học của tetrahedral. GÓc của liên kết trung tâm O-Si-O rất gần với giá trị ở một tetrahedron lý tưởng (109.5°, màu xanh xám trong hình Fig.1), cùng với khoảng cách oxy-silicon khoảng 0.161 nm đối với tất cả các nguyên tử oxy, nên tetrahedron riêng lẻ có một cấu trúc tương đối cân xứng bậc ba[6].
uanh nguyên tử silicon giữ chúng ở khoảng cách xa nhất có thể, nên chúng hình thành bốn góc của met tetrahedron, được tượng trưng bởi hình chop xám trong mờ. Lưu ý rằng nguyên tử oxy không được liên kết với nhau, những đường xám giữa chúng chỉ được vẽ lên để tượng trưng cho hình học của tetrahedral. GÓc của liên kết trung tâm O-Si-O rất gần với giá trị ở một tetrahedron lý tưởng (109.5°, màu xanh xám trong hình Fig.1), cùng với khoảng cách oxy-silicon khoảng 0.161 nm đối với tất cả các nguyên tử oxy, nên tetrahedron riêng lẻ có một cấu trúc tương đối cân xứng bậc ba[6].
Liên kết Si-O ngược nhau cao, với các electron bị hút bởi oxy, dẫn đến sự phân bố không đều điện tích trong tetrahedron: các góc nhiều điện tích âm, trung tâm nhiều điện tích dương.
Nhiều phân tử riêng lẻ được xây dựng như O=Si=O (với một cấu trúc dài hẹp như cấu trúc của CO2) chỉ có thể được tìm thấy trong một khí SiO2 ở nhiệt độ trên 2500°C.
Nhiều sách giáo khoa giải thích hình học của SiO4-tetrahedron và các cấu trúc khoáng được quyết định bởi kích cỡ có liên quan của các ion khác nhau, như được thể hiện trong hình Fig.2: Kích cỡ liên quan lớn hơn của các ion trung tâm, càng nhiều ion có điện tích trái dấu cần thiết được đính kèm với nó. Do đó, tetrahedron SiO4 thường được vẽ như một ion dương nhỏ Si4+ đính kèm bởi bốn ion âm lớn O2- (Fig.3). Người ta tranh luận rằng điều này không chính xác: Silicon và Oxy được liên kết với nhau bởi những liên kết đồng hóa trị, nên chúng hình thành một đơn vị, và không ở trong cách thức tương tự bị phân chia và có thể di động tự do như các ion trong muối. Các hợp chất với Si4+ trên thực tế khoong tồn tại. Có một vài biến thể trong sự giải thích của các vật được thí nghiệm, và trong đó một số tác giả coi liên kết Si-O như là một đồng hóa trị chủ yếu, số khác lại nhấn mạnh đặc tính ion của liên kết. Xem xét lại, xem Gibbs et al., 1994 và Cohen, 1994.,
Oxy có hóa trị hai và nguyên tử oxy trong các góc của tetrahedron được liên kết với met nguyên tử silicon khác trong một tetrahedron bên cạnh. Vì vậy, thạch anh, và silica nói chung, có thể được mô tả như một mạng liên kết ba chiều của liên kết tetrahedral SiO4. Một cái nhìn giản lược về cấu trúc của nó trong các biểu tượng hóa học được thể hiện trong hình Fig.4. Nhiều con số chi tiết về cấu trúc phân tử của thạch anh được tìm thấy trong chương Cấu trúc.
Liên kết SI-O-Si nối với hai tetrahedral không thẳng (180°), nhưng hình thành met góc 144° trong thạch anh (Fig.5). Kêt quả là, cấu trúc tổng quan của tinh thể thạch anh khá phức tạp. Trong những biến thể khác của silica, góc này khác hẳn, trong khi những góc trong tetrahedral SiO4 (được định nghĩa bởi liên kết O-Si-O) về cơ bản là giống nhau. Bảng dưới đây liệt kê các góc và khoảng cách cho một số định dạng silica.
| Biến thể |
Góc
Si-O-Si |
Khoảng cách
Si-O
/ nm |
| α-thạch anh[8] |
144° [1]
143.6°[3] |
0.16101-
0.16145 [2] |
| β-thạch anh[8] |
153° [1] |
0.162 [1]
0.1609 [2] |
| α-Cristobalite |
147° [1] |
0.160-0.161 [1] |
| β-Cristobalite |
151° [1] |
0.158-0.169 [1] |
| α-Tridymite |
ca.140° [1] |
0.154-0.171 [1] |
| β-Tridymite |
180° [1] |
0.153-0.155 [1] |
Dữ liệu từ:
[1] ➛Hollemann & Wiberg, 1985 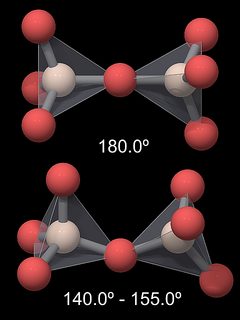
[2] ➛Rykart, 1995
[3] Kích thước với JMol dựa trên tọa độ đơn vị tế bào.
Oxy vốn có khuynh hướng hình thành một liên kết góc X-O-X, như những chất xung quanh nó trong hệ thống các nguyên tố tuần hoàn. Fig.6 cho thấy những mẫu của bốn hợp chất hydro, nước (H2O), metan (CH4), ammonia (NH3), và silane (SiH4). Khoảng cách nguyên tử và kích cỡ liên quan của C, N, O và Si theo tỷ lệ, nhưng nguyên tử hydro ngoại khổ cho tính đọc. Nguyên tử CH4 và SiH4 hiển nhiên là tetrahedral. NH3 và H2O có dạng gần giống như phân tử metan với 1 hoặc 2 nguyên tử hydro bị tách rag, với một góc H-O-H 104.5° và góc H-N-H 106.8°. Lý do cho sự giống nhau này đó là hình học của wuyx đạo electron liên kết với nhau, bốn cái được gọi là quỹ đạo hybrid sp3, hình thành nên một tetrahedron. Một sắp xếp quỹ đạo hybrid cũng được tìm thấy trong silicon và là lý do chủ yếu cho hình dạng tetrahedron và độ cứng của SiO4 trong silica và silicates.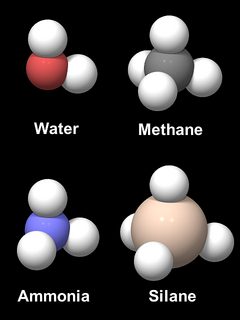
Từ điều này, người ta có thể hy vọng góc của liên kết Si-O-Si nhỏ hơn, vậy nên tại sao nó lại mở rộng nhiều hơn? Về điều này, do liên kết Si-O có tính phân cực cao và các nguyên tử oxy bị phân cực âm tính, có nhiều lực đẩy giữa các nhóm SiO4, và met liên kết Si-O-Si thẳng sẽ giúp giữ nguyên tử oxy ở khoảng cách xa hơn. Thêm vào đó, chiều dài của liên kết Si-O ngắn hơn so với được tính toán một liên kết: giá trị nên là 0.181 nm nhưng trên thực tế là khoảng 0.161 nm trong thạch anh và có các giá trị tương tự trong các biến thể silica khác. Đây là một sự biểu thị cho đặc tính liên kết đôi một phần của liên kết này ((Hollemann & Wiberg, 1985), điều đó cũng giải thích nồng độ cao của nó. Liên kết đôi này tương quan với góc Si-O-Si được mong đợi là lớn hơn (144° thay vì 109.5°). Lưu ý rằng khoảng cách Si-O là ngắn nhất trong β-tridymite, và biến thể này có góc Si-O-Si 180°. Học thuyết đằng sau đặc tính liên kết đôi một phần này tương đối phức tạp và tôi sẽ không đi sâu vào nó.
Silica and Silicates
Mặc dù về mặt hóa học silica là một oxit, trong tài liệu khoáng học Angloamerican, thạch anh và tất cả các biến thể silica thường được phân loại như các silicates (dựa trên hệ thống phân loại được lập ra bởi Dana). Lý do đằng sau việc gọi thạch anh là một silicate đó là nó được xây dựng lên bởi một mạng tetrahedron SiO4. Silicates được phân loại theo cách tetrahedron SiO4 được tích hợp vào cấu trúc tinh thể và cách tetrahedron được liên kết với nhau, và theo đó thạch anh được gọi là tectosilicate (“mạng lưới silicate” hoặc silicate khung”)
Một silicate là met muối của các axit silicic và một hay một số kim loại. Axit orthosilicic H4SiO4, chỉ là dạng đơn giản nhất, các axit silicic khác được tạo thành tử một vài đơn vị SiO4 được liên kết với hydro.
Người ta cho rằng silicates hình thành khi met hydroxide kim loại và axit orthosilicic phản ứng, như:
H4SiO4 + 2 Mg(OH)2 → 2 H2O + Mg2SiO4 [11]
nhưng điều này không phải cách mà silicates thường hình thành trong tự nhiên. Silicates có thể được hình thành khi một oxit kim loại hay carbonate phản ứng với silica, như:
SiO2 + 2 FeO → Fe2SiO4 [12]
Những phản ứng tương tự thực tế có xảy ra trong tự nhiên, sự hình thành wollastonite trong quá trình biến chất đá đã được đề cập đến trước đó (phản ứng [4]). Nhưng sự hình thành silicate theo cách thông thường đó là một sự chuyển đổi: silicate phản ứng với nhau để tạo thành silicate mới. Ngay khi tetrahedron SiO4 được hình thành, nó dễ dàng bị vỡ đôi, và chỉ có thể dùng trong phản ứng tạo thành vòng, chuỗi, tấm, hhay mạng lưới tetrahedron. Chỉ rất hiếm và trong các môi trường đặc biệt người ta mới có thể tìm thấy silicon trong các khoáng không có silicate.
Độ nguyên chất của các tinh thể thạch anh
Không giống như phần lớn các khoáng chất, một tinh thể thạch anh trong suốt về mặt hóa học luôn luôn trong, với dung lượng SiO2 lên tới 99.5%, thường hơn. Về cơ bản, có hai lý do cho điều này.
Đầu tiên, thạch anh có một cấu trúc phân tử lớn. Nó không chứa các ion riêng biệt với một vài nguyên tố có thể dễ dàng bị thay thế bởi các nguyên tố khác. Ví dụ, nếu một muối (một hợp chất được tạo thành bởi các ion tách biệt được xếp gần nhau bởi các lực tĩnh điện) mọc ra trong dung dịch nước, các ion của nó có thể được tự ý thay thế miễn là kích cỡ cà điện tích của ion thay thế có giá trị giống nhau. Khi thạch anh mọc ra từ dung dịch nước, thật ra không có gì “hấp dẫn” trên bề mặt đang mọc lên tới các ion khác trong dung dịch. Ví dụ, chỉ khi một nhóm đơn vị [AlO4]– được thiết lập thay vì một đơn vị SiO4, cấu trúc về mặt điện tích sẽ không cân bằng và cho phép một vài ion dương đơn trị (phần lớn là H+, nhưng cũng có Na+ hay Li+) trong đó. Chỉ một vài nguyên tố đáp ứng chỉ tiêu có vai trò thay thế silicon trong đơn vị SiO4 như là nhôm [AlO4]–, photpho trong [PO4]+, hay sắt trong [FeO4]– và gây ra thể vùi nhiều sắt khác. Thú vị là, khoáng berlinite AlPO4, nó có thể được hiểu như công thức [Al,P]O2 là một thể đồng hình về cấu trúc của thạch anh, cho thấy phần lớn thuộc tính đối xứng và về cấu trúc giống nhau, và các thuộc tính vật lý giống nhau.
| |
Công thức |
Hệ tinh thể |
Mật độ |
Độ cứng |
Độ khúc xạ |
| Berlinite |
AlPO4 |
trigonal |
2.64 g/cm3 |
7 |
1.524-1.530 |
| α-Quartz |
SiO2 |
trigonal |
2.65 g/cm3 |
7 |
1.544-1.553 |
Thứ hai, cấu trúc ba chiều của tetrahedron ba chiều khá cứng. Nhiều khoáng chất có thể chịu được lượng tương đối lớn những nguyên tử khác và/ hoặc ion trong mạng tinh thể không cho thấy những độ lệch lớn trong thuộc tính vật lý[9]. Màu sắc có thể thay đổi hoàn toàn, nhưng các tinh thể có vẻ trong suốt và đồng nhất, do nhìn chung mạng tinh thể có chút linh hoạt hoặc rộng lớn và duy trì cấu trúc ban đầu của nó. Tuy nhiên, mạng tinh thể của thạch anh đều chặt và cứng (làm nó rắn nhưng giòn), và chỉ lượng nhỏ các nguyên tố khác cùng với các ion dương nhỏ (thường là Li, Na, H) có thể được tạo thành trong quá trình sinh trưởng mà không phá vỡ cấu trúc mạng tinh thể. Và thực tế lượng ion dương đơn trị được tìm thấy trong thạch anh tương đối cân xứng với lượng nhôm. Thạch anh có chứa lượng lớn hơn các chất khác trong suôt mờ đục, và thường đục, bởi tinh thể “mọc quanh” những khoáng xung quanh, và ánh sáng được rải rác ở viền những vật chất khác.
Điều này thường không đúng đối với các biến thể khác của silica, và có vẻ rằng đối với một vài trong số chúng sự hiện diện của các nguyên tố được theo dấu trên thực tế có ảnh hưởng ổn định trên cấu trúc của chúng.
Nhưng trong khi cấu tạo chung của các tinh thể thạch anh trong suốt đặc biệt tinh khiết (ít nhất khi được so sánh với hầu hết các khoáng chất khác), sự tinh khiết không được phân bố đồng đều trong tinh thể. Độ tập trung các nguyên tố có thể biến đổi do thứ tự độ lớn trong một vài khoảng cách thước đo. Ví dụ, độ tập trung nhôm có thể biến đổi giữa ít hơn 5ppma (phần trên triệu nguyên tử) tới 10000ppma trong tinh thể đơn (➛Perny et al. 1992). Mẫu của sự phân china các nguyên tố có thể dễ nhận thấy với một phương pháp được gọi là phát quang ở âm cực: chum electron năng lương cao (“tia âm cực”) mang lại hiệu ứng phát quang ngắn hạn có thể bắt được trong phim thường. Hình ảnh kết quả của các mảnh mỏng của tinh thể cho thấy một mẫu phiến nhỏ. Các lớp đều nằm song song với mặt tinh thể, tương tự với ảo ảnh, nên mẫu phân bố nguyên tố này được gây rag bởi sự thay đổi nhanh chóng trong môi trường sinh trưởng.
Về mặt hóa học, độ tinh khiết van không đủ trong cho mục đích kỹ thuật. Một tinh thể đồng nhất hoàn hảo trong như chân không, nhưng các nguyên tố theo dấu gây ra biến dạng và khuyết điểm trong mạng tinh thể, và ngược lại điều này ảnh hưởng các thuộc tính quang học. Hầu hết các nguyên tố được tạo thành trong thạch anh (H, Li, Al, Na, Ti, Fe) có ở khắp nơi và sự tinh chế của silica rất phức tạp và đắt. Vì lý do đó, các quặng thạch anh với phân lượng nguyên tố xung quanh thấp vẫn được tìm thấy sau đó
Chú thích:
1 IUPAC là một tổ chức hướng tới mục đích xóa bỏ sự lưỡng nghĩa nhưng là những cái tên quen thuộc như Knallsäure (tiếng Đức là “axit trôi”, axit fulminic) từ thuật ngữ hóa học. Các tên gọi cũ vẫn tồn tại miễn là chúng rõ nghĩa.
2 Một vài người thấy nó thật hấp dẫn làm một vài thí nghiệm với hydro florua. Hydro florua là một chất rất nguy hiểm. Chỉ cần nhìn vào một trường hợp trong một cuốn sách giáo khoa tốt về khoa chất độc, sau bài giảng, bạn sẽ không muốn chạm vào nó thậm chí với một chút. Dung dịch nước không phải là một axit mạnh (nhưng HF tinh khiết là một dung dịch mạnh), và các phân tử HF nhỏ không hòa tan dễ dàng thâm nhập vào da và liên kết với canxi trong các tế bào để hình thành fluorite không tan, CaF2. Canxi rất cần thiết cho các chức năng sống của các tế bào trong cơ thể. Một lượng nhỏ trên một ngón tay không chú ý có thể gây thương tổn – sau một lúc trì hoãn- có thể dẫn tới thiệt hại đáng kể và đau đớn.
Hãy làm nhanh bài toán sau: 1 Mol HF = 20g. Một giọt (khoảng 50 μl) của 20% dung dịch chứa 0.00005 l x (200g/l) = 0.01 g. 10 mg.
1 Mol Ca = 40g và 1 Mol F = 19g. 1 Ca sẽ liên kết 2 F, rồi 40g Ca sẽ liên kết 38g F từ 40g HF. 1 ml trong mô tế bào chứa khoảng 0.1mg Ca, và 0.1mg HF sẽ làm nó kết tủa hoàn toàn. Theo lý thuyết, 10mg HF trong giọt nhỏ có thể kết tủa gần Ca in 100 ml tế bào, giết chết tất cả các tế bào trong nó.
3 Thuật ngữ “meteoric water” đề cập tới nguồn gốc của nó từ không khí, không phải từ thiên thạch. Người Hy Lạp cho rằng sao băng đến từ khu vực tương tự như trong các đám mây: Sao và các hành tinh được xem như vật bên ngoài, điều mà mây và sao băng hiển nhiên là không phải. Nghĩ tới “khí tượng học”
4 Đó là lý do tại sao thạch anh trong đá núi lửa thường đi kèm với canxit
5 Điều này đôi khi phản lại trực giác, nhưng một dung dịch bão hòa ở trong một cân bằng thủy phân với tinh thể. Khi một phân tử được sáp nhập vào trong một cấu trúc tinh thể, những liên kết mới sẽ được hình thành, và phụ thuộc vào hình dạng của cấu trúc tinh thể, có thể là năng lượng được thải ra hay tiêu thụ. Để hòa tan một chất, năng lượng cần thiết để phá vỡ các liên kết, nhưng năng lượng cũng được thải rag khi các phân tử nước định hướng chúng về phía phân tử được hòa tan và hình thành liên kết tĩnh điện mới. Một biến thể ổn định hơn của một hợp chất nhìn chung ít tan hơn, bởi nhiều năng lượng hơn cần có để phá vỡ liên kết.
Không gì có thể giải quyết vấn đề này ngoài trừ tốc độ phản ứng. Dưới những điều kiện nhất định, một biến thể ổn định hơn sẽ hình thành trước tiên từ một dung dịch và chỉ sau khi nó được thay thế bằng biến thể ổn định. Thạch anh tinh thể kín đặc biệt hình thành từ một dung dịch nước nhưng với các bước ngay lập tức cristobalite và opal, bởi động học của phản ứng thiên về hình thành opal. Và khi bạn cho một tinh thể thạch anh vào 1 lit nước tinh khiết ở nhiệt độ trong phòng, bạn có thể chắc chắn rằng khi bạn lấy nó ra vào hôm sau, nó sẽ không nặng hơn 2.9mg. Có lẽ nó sẽ nặng để đo được độ khác biệt. Có lẽ, sau một tháng hoặc sau một năm.
6 Tetrahedron trong thạch anh trên thực tế hoàn toàn không cùng kích thước như tetrahedron lý tưởng, nhưng hơi lệch, bởi khoảng cách tới nguyên tử silicon trung tâm là 0.16101 nm cho hai nguyên tử oxy, và 0.16145 cho hai nguyên tử oxy khác. Tuy nhiên, độ lệch này từ công thức lý tưởng không đáng kể đối với các mục đích thực tế, bởi nó chỉ nhỏ hơn 0.3%.
7 Chỉ số oxy hóa của Si và O là +4 và -2, một cách tương ứng. Năng lượng cần thiết trên thực tế để đẩy 4 electron từ Si là quá cao để thực hiện một liên kết ion ổn định. Thậm chí SiF4 là một hợp chất với điện cực, nhưng là những liên kết đơn trị, much dù độ âm tính của fluorine cao. Nhưng hợp chất âm tính Si4- có tồn tại (như là Ca2Si).
8 Rykart (1995) đưa ra các giá trị 152.8° và 143.5° cho thạch anh α- và β-, một cách tương ứng. Điều này có vẻ như là một lỗi trong in ấn, những giá trị nên được chuyển đổi.
9 Nhưng nó không đúng rằng mọi thứ đều có thể. Khi một khoáng hình thành, các nguyên tố và ion được xây vào mạng tinh thể của nó khi chúng đáp ứng chỉ tiêu, như một điện tích cụ thể, kích cỡ hoặc độ âm điện, và rôi tương tự như những nguyên tố trước đó hình thành mạng tinh thể.
– Phạm Thị Hòa dịch



















